Tonisitet
- For isotone nukleotidar i kjernefysikk, sjå isoton.
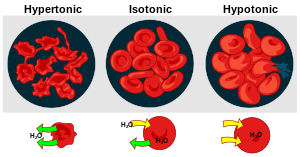
Tonisitet er ei måling for det effektive osmotiske trykket, målt langs ein gradient, mellom to løysingar som er delt av ein semipermeabel membran. Med andre ord er det den relative konsentrasjonen av løysingar som avgjer retninga og storleiken av diffusjon.
Hypertonisitet[endre | endre wikiteksten]
Hyperton eller hypertonisk visar til høgare konsentrasjon. I biologien er ei løysing hypertonisk når dei oppløyste stoffa utanfor cella har høgare konsentrasjon enn dei som er inni cella.
Hypotonisitet[endre | endre wikiteksten]
Hypoton eller hypotonisk visar til lågare konsentrasjon. I biologien er ei løysing hypotonisk når dei oppløyste stoffa utanfor cella har lågare konsentrasjon enn dei som er inni cella.
Isotonisitet[endre | endre wikiteksten]
Isoton eller isotonisk (frå gresk isos 'lik' og tonos 'spenning') nytta i samband med osmose viser til at to løysingar har likt osmotisk trykk. Omgrepet er nytta innanfor medisinen, der det gjerne er forstått som med same osmotisk styrke som blodvæske. Til dømes kallar ein ei løysing på 9 mg/ml NaCl i vatn for ei isoton løysing.
Sjå òg[endre | endre wikiteksten]
Kjelder[endre | endre wikiteksten]
- Audun Øyri: Norsk medisinsk ordbok. Oslo, 1988.
