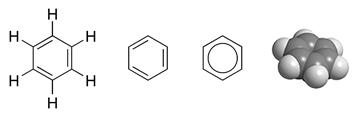
Benzen
| Nemningar | |
|---|---|
| Formel | C6H6 |
| Kjemisk namn | benzen |
| Andre namn | benzol |
| Identitetsnummer | CAS: [71-43-2] |
| Eigenskapar | |
| Relativ molekylmasse | 78,11 u |
| Tettleik | 0,7865 g/cm3 |
| Smeltepunktsintervall | 5,5 |
| Når ikkje anna er oppgjeve gjeld tala for eit stoff ved standardtilstand (25 °C, 100 kPa) | |
| Struktur | |
| Stoffgruppe | Aromat |
 | |
Benzen (C6H6) er ei kjemisk sambinding. Det er eit fargelaust, brennbart og aromatisk hydrokarbon som er prova kreftframkallande.
Ein kan framstilla stoffet gjennom reduksjon av visse karbonsambindingar eller frå olje. Det blir brukt ved syntetisk framstilling av stoff som legemiddel, plast, bensin, kunstgummi, napalm og fargestoff, anten som reaktant eller som løysemiddel.
Historie[endre | endre wikiteksten]
Benzen vart oppdaga i 1825 av den britiske kjemikaren Michael Faraday, som framstilte det i rein form frå naturgass og gav det namnet brintbikarburat. I 1833 laga den tyske kjemikaren Eilhard Mitscherlich stoffet ved destillering av benzosyre og brent kalk. Han gav det namnet benzin. I 1849 innleia Charles Mansfield den første industrielle produksjonen av benzen frå koltjøre.
Struktur[endre | endre wikiteksten]
Formelen for benzen (C6H6) var eit mysterium i ein periode etter at stoffet vart kjend. Ingen av dei foreslåtte strukturformlane kunne nemleg forklara bindingane i stoffet. Dette fordi karbon vanlegvis dannar fire bindingar og hydrogen berre ei.
Løysinga ligg i å sjå på bindingane som elektronbanar, orbitalar. Det følgjande diagrammet syner plasseringa av desse orbitalane:
Sidan orbitalane ligg utanfor planet til atoma, kan dei påverka kvarandre fritt. Dermed vert dei forskuve. Det gjer at alle seks karbonatoma deler på elektrona i staden for at dei er bundne til eitt karbonatom. Det er ikkje nok elektron til å danna dobbeltbindingar mellom alle karbonatoma, men dei «ekstra» elektrona styrkar alle bindingane i ringen like mykje. Molekylorbitalen som vert danna har π-symmetri.
Denne forma for forskyving av elektron vert kalla aromatisk, og den gir benzen stor stabilitet. Det er den grunnleggjande eigenskapen ved aromatiske stoff i motsetnad til dei ikkje-aromatiske stoffa.
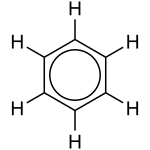
For å vise den forskovne naturen til bindingane på eit strukturdiagram, kan ein teikne benzen som ein sirkel inni ein sekskant:
Hydrogenatoma vert ofte utelatne frå diagrammet.
Benzen opptrer så ofte i organiske molekyl at det har fått sitt eige Unicode-symbol: ⌬
Substituentar[endre | endre wikiteksten]
Mange viktige, kjemiske stoff er grunnleggjande benzen, der eitt eller fleire karbonatom er erstatta av andre atom eller grupper, til dømes:
Karbongrupper
Andre funksjonsgrupper
- trinitrotoluen (sprengstoffet TNT)
- fenol
- pikrinsyre
- anilin
Polysykliske sambindingar
Heterosykliske ringar – Karbonatom i ringen er erstatta med noko anna.
- pyridin
- furan er ustabilt, men derivatet tetrahydrofuran (THF) er mykje bruka som løysemiddel og utgangsstoff for kjemiske reaksjonar.
Bruk[endre | endre wikiteksten]
Før 1920-åra vart benzen ofte brukt som løysemiddel i industrien, særleg til avfeitting av metall. Etter at ein har vorte klar over kor giftig stoffet er, har andre middel erstatta benzen i dei tilfella der menneske er direkte utsett for dampane.
Bruka som tilsetting i bensin gjer benzen eit høgare oktantal, noko som hindrar «banking» i motoren. I løpet av 1950-åra gjekk ein i staden over til å nytte tetraetylbly, men den stigande blyforureininga gjorde at ein i dag er tilbake til benzen som additiv i motorbensin, som vert seld med eit innhald på om lag 5 %.
Den desidert viktigaste bruken av benzen er som utgangspunkt for syntesen av andre stoff. Blant dei mest nytta benzenderivata kan ein nemne styren, som blir brukt i polymerisert form til framstilling av plast (polystyren), fenol, som vert nytta til framstilling av kunstharpiks og lim, og cyclohexan, som vert nytta til framstilling av nylon. Mindre mengder av benzen vert nytta til framstilling av kunstgummi, smøremiddel, fargestoff, rensemiddel, medisin, sprengstoff og kjemiske stridsmiddel.
Helserisiko[endre | endre wikiteksten]
Benzen har både akutt og kronisk giftverknad på menneske. Ved å puste inn gassane vert ein trøytt, svimmel, forvirra og får auka puls. I alvorlege tilfelle kan ein miste medvita eller døy av gassane. Får ein stoffet inn gjennom mat kan det framkalle oppkast, mageirritasjonar, ørske, trøyttleik, krampar, høg puls eller i verste fall død.
Er ein i kontakt med stoffet over lang tid, kan det oppstå skadar på mergen, anemi, svekking av immunforsvaret og auka risiko for infeksjonar. Foster kan verta skada slik at dei får låg fødselsvekt, forseinka mergutvikling og mergskadar. Det amerikanske helsedepartementet hevdar dessuten at stoffet er kreftframkallande, siden det kan føre til leukemi.
Difor har eit EU-direktiv frå 2000 fastlagt grenseverdiar for benzen og karbonmonoksid (Europaparlament- og rådsdirektiv 2000/69/EF av 16. november 2000 om grenseverdiar for benzen og karbonmonoksid i lufta. EF-Tidende L 313 av 13.12.2000 s.12 ): Det er fastsett ein grenseverdi på 5 µg/m3 målt som årsgjennomsnitt. Grenseverdiane vart bindande frå 2010.
Bakgrunnsstoff[endre | endre wikiteksten]
- Kulstofbindinger
- Benzens struktur Arkivert 2009-01-02 ved Wayback Machine.
- Annulen
- Enkle aromatiske ringar
- Aromatiske hydrokarbon
- Hydrokarbonløysemiddel
- Sykliske sambindingar med 6 atom
- Funksjonelle grupper
- Immuntoksin
- Mutagen
- Teratogen
- Arbeidsmiljø
- Bulkkjemikal
- Petrokjemikal
- Positive allosteriske GABAA-reseptormodulatorar
- Karsinogen i IARC-gruppe 1
- Helsefarleg luftforureining
- Jordforureining