Hemoglobin

Hemoglobin, ofte avkorta Hgb eller Hb, er eit protein som finst i blodet hjå pattedyr og andre dyr og har i oppgåve å transportera oksygen til cellene og karbondioksid vekk frå dei. Hemoglobin finst i dei raude blodlekamane. Det er eit metallprotein som inneheld mykje jarn, og er det stoffet som fargar blodet raudt.
Mangel på hemoglobin fører til anemi. Mutasjonar i genet til hemoglobinproteinet fører til ei gruppe arvelege sjukdommar som vert kalla hemoglobinopatiar. Dei mest kjende av desse er sigdcelleanemi og thalassemi.
Namnet hemoglobin er samansett av heme og globin, globin er ei nemning på eit globulært protein. Sidan ei einskild undergruppe av hemoglobin er danna av ei hemegruppe innlagd i eit globulært protein, er denne nemninga dekkjande. Globinet består av fire undergrupper, der kvar av desse bind til seg ei hemegruppe (eller haemgruppe). Hemegruppene er organiske molekyl, og at kvar av dei inneheld eit jarnatom er naudsynt for at oksygen kan binda seg til molekylet.
Struktur[endre | endre wikiteksten]
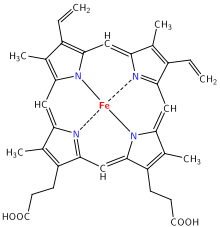
I kvar undergruppe i hemoglobinmolekylet er der ei hemegruppe. Ei hemegruppe består av eit jarnatom bunde i ein heterosyklisk ring, kalla porfyrin. Dette jarnatomet er staden som oksygen bind seg til. Jarnatomet bind seg likt til dei fire nitrogenatoma i sentrum av ringen, desse ligg i same planet. I tillegg kan det dannast to bindingar til, loddrett på dette planet, ein på kvar side. Dette dannar den femte og sjette forma til molekylet. Jarnatomet kan enten vera toverdig, Fe+2 eller treverdig, Fe+3, men ferrihemoglobin (methemoglobin, Fe3+) kan ikkje binda oksygen. Alle hemoglobinmolekyl inneheld enten to α- eller to ξ-kjeder.
Hjå vaksne menneske er det mest vanlege hemoglobinet ein tetramer (inneheld fire undergrupper protein), hemoglobin A, som består av to α- og to β-grupper bundne saman med ikkje-kovalente bindingar. Undergruppene liknar kvarandre strukturelt, og er av om lag same storleik. Kvar undergruppe har ei molekylvekt på om lag 16 000 Dalton, dette vert ei total molekylvekt for heile tetrameren på 64 000 Dalton. Hemoglobin A er det hemoglobinmolekylet som er mest utførleg granska.
Kvaternær struktur[endre | endre wikiteksten]
Dei fire polypeptidkjedene er samanbundne med hydrogenbindingar og hydrofob interaksjon. Der er to kontakttypar mellom α- og β-kjedene: α1β1 og α1β2.
Hemoglobintypar[endre | endre wikiteksten]
Føtalt hemoglobin:
- Gower 1 (ξ2ε2)
- Gower 2 (α2ε2)
- Hemoglobin Portland (ξ2γ2)
Hemoglobinar hjå vaksne (d.v.s. hemoglobinar som vaksne har, i motsetnad til hemoglobinar som berre finst i fosterlivet):
- Hemoglobin F (α2γ2) - Hjå vaksne finst Hemoglobin F berre i ein fåtallig type raude blodlekamar som vert kalla F-celler.
- Hemoglobin A (α2β2)
- Hemoglobin A2 (α2δ2) - δ-kjedesyntesen startar seint i det tredje trimester i fosterlivet og hjå vaksne, det utgjer normalt om lag 2,5 % av hemoglobinet hjå vaksne.
Ligandbindingar[endre | endre wikiteksten]
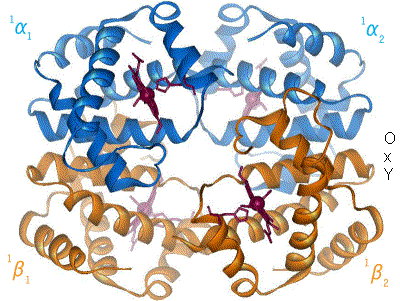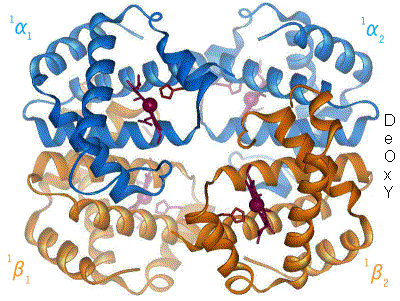
I den tetramere forma til normalt hemoglobin hjå vaksne menneske (adult hemoglobin), er bindinga til oksygen ein kooperativ prosess. Hemoglobinet sin affinitet (tiltrekking) til oksygen aukar med oksygenmettinga til molekylet. Følgja av dette er at oksygenet si bindingskurve til hemoglobin er sigmoidal eller S-forma, i motsetnad til ei normal hyperbol (ikkje-kooperativ) kurve. Denne positive kooperative bindinga vert oppnådd gjennom romlege steriske endringar i hemoglobinkomplekset: Når ei av proteinundergruppene i hemoglobinet vert oksygenert, fører dette til strukturendring i heile komplekset som aukar dei tre andre undergruppene si tiltrekking til oksygen.
Hemoglobinet si tiltrekking til oksygen er nedsett når det er karbonmonoksyd (CO) tilstades, fordi båe gassane tevlar om den same bindingsstaden på hemoglobinet. Hemoglobin bind seg sterkare til karbonmonoksyd enn til oksygen. Karbondioksyd (CO2) har ein annan bindingsstad på hemoglobinmolekylet. Karbondioksyd reagerer med vatn og dannar bikarbonat gjennom ein reaksjon som vert katalysert av enzymet karbon anhydrase:
- CO2 + H2O <-> HCO3- + H+

Blod med høgt innhald av karbondioksid har også lågare pH (er surare) enn om innhaldet er lågt. Hemoglobin kan binda protonar og karbondioksyd, dette skapar ei strukturell endring i proteinet og lettar frigjevinga av oksygen. Protonar bind seg til ulike stader på proteinet, og karbondioksyd bind seg til alfa-aminogroupper og dannar karbamat. Motsett er det slik at når konsentrasjonen av karbondioksyd i blodet går ned, til dømes i lungene, vert karbondioksyd frigjeve der. Dette aukar hemoglobin si tiltrekking til oksygen. Denne kontrollen av hemoglobinet si evne til å binda oksygen, ved å binda og frigjeva karbondioksyd, er kjend som Bohreffekten.
Bindinga til oksygen vert påverka av molekyl som til dømes karbonmonoksyd (CO). Dette kan koma frå tobakkrøyk eller utslepp frå bilar eller eldstader. CO tevlar med oksygen om bindingsstaden på hemegruppa. Hemoglobin bind seg til til CO 200 gonger sterkare enn til oksygen. Dette medfører at sjølv små mengder CO vil redusera hemoglobinet si evne til å transportera oksygen dramatisk. Når CO bind seg til hemoglobin, vert det danna ei lyseraud forbinding kalla karboksyhemoglobin, denne kan gje synleg endring i hudfargen. Når lufta eit menneske andar inn inneheld eit CO-nivå så lågt som 0,02 %, vil det få hovudverk og kvalme, aukar konsentrasjonen av CO til 0,1 %, vil det falla i uvit. Hjå storrøykjarar kan så mykje som 20 % av bindingsstadane til oksygen vera blokkerte av CO.
Hemoglobin har også kompetitiv (konkurrerande) tiltrekking til svolvemonoksyd (SO), nitrogendioksyd (NO2) og hydrogensulfid (H2S). Jarnatomet i hemegruppa må vera toverdig (Fe+2) for å kunna transportera oksygen. Oksydering til treverdig jarn (Fe+3) omdannar hemoglobin til ferriglobin eller methemoglobin som ikkje kan binda til seg oksygen. Nitrogendioksyd og nitrogenoksyd er i stand til å omdanna hemoglobin til methemoglobin.
Hjå menneske som oppheld seg i store høgder, er konsentrasjonen av 2,3-difosfoglycerat (2,3-DPG) i blodet auka. Dette fører til at desse menneska er i stand til å frigjeva større mengder oksygen frå hemoglobin til kroppsveva sjølv om oksygentrykkket er lågt. Dette fenomenet, der molekyl Y påverkar bindinga til molekyl X i eit transportmolekyl Z, vert kalla ein heterotrop allosterisk effekt.
Ein variant av hemoglobin, føtalt hemoglobin (Hb F, α2γ2), finst i fosterlivet, og bind til seg oksygen sterkare enn hemoglobin hjå vaksne (adult hemoglobin) gjer. Følgjeleg ligg det føtale oksygenet si dissosiasjonskurve lenger til venstre enn den for adult hemoglobin, det vil seie at ein større del av hemoglobinmolekylane har bunde til seg oksygen ved eit lågare oksygentrykk enn det som er tilfellet hjå adult hemoglobin (sjå figur ovanfor).
Nedbryting av hemoglobin[endre | endre wikiteksten]
Når dei raude blodlekamane døyr (etter ei levetid på ca. 120 dagar), vert dei brotne ned, og hemoglobinmolekyla vert oppløyste slik at jarnet kan brukast på nytt. Porfyrinringen vert oppdelt og fragmenta vanlegvis utskilde i gallen frå levra. Hovudproduktet frå nedbrytinga av heme er bilirubin. Ein kan finna auka mengder av dette stoffet i blodet dersom raude blodlekamar vert øydelagde i større mengder enn vanleg (sjå gulsott eller icterus). Ufullstending nedbrote hemoglobin eller hemoglobin som har kome seg ut av blodlekamane, kan danna proppar og tetta til små blodårer, særleg i dei tynnaste årene i nyrene som filtrerer blod, og på denne måten gje nyreskade.
Andre oksygenbindande protein[endre | endre wikiteksten]
I tillegg til hemoglobin er der i dyre- og planteriket ei mengd andre protein som har evna til å binda til seg oksygen. Andre organismar som til dømes bakteriar, protozoar og soppar har alle hemoglobinliknande protein som mellom anna tek seg av den reversible bindinga til ligandar i gassform.
Dei to vanlegaste er:
- Myoglobin: Finst i muskelvevet til mange vertebratar, inkludert menneske. Det gjev ein tydeleg raud eller mørk grå farge til muskelvevet. Det liknar sterkt hemoglobin i struktur og sekvens, men er ikkje ein tetramer, men monomer. Myoglobin manglar kooperative bindingar og har til oppgåve å lagra oksygenet framfor å transportera det.
- Hemocyanin: Er det andre mest vanlege oksygentransporterande proteinet som er funne i naturen. Det er påvist i blodet til mange arthropodar and mollusklar. Det har ei kopargruppe i staden for jarnhemegrupper og får ein blå farge når det vert oksygenert.
Hemoglobin si rolle i sjukdommar[endre | endre wikiteksten]
Nedsette mengder hemoglobin, med eller utan nedgang i talet på raude blodlekamar, medfører symptom på anemi (blodmangel). Anemi har mange ulike årsaker, sjølv om jarnmangel som fører til jarnmangelanemi er den mest vanlege årsaka i den vestlege verda. Ved jarnmangel vert syntesen av heme nedsett, dei raude blodlekamane vert hypokrome, det vil seie at dei inneheld mindre av det raude hemoglobinpigmentet, og dei vert mindre enn vanleg, mikrocytiske. Andre anemitypar er meir sjeldne. Ved hemolyse, auka nedbryting av raude blodlekamar, kan ein sjå gulsott (icterus) fordi hemoglobinmetabolitten bilirubin hopar seg opp i huda.
Mutasjonar i globinkjeda kan ha tilknyting til haemoglobinopathiar, som til dømes sigdcelleanemi og thalassemi.
Ei gruppe genetiske feil i hemesyntesen er dei såkalla porfyrisjukdommane. Kong George III av Storbritannia er truleg den mest kjende personen som hadde ein slik sjukdom.
I ein liten grad vil hemoglobin A binda til seg glukose på ein spesiell stad på molekylet. Det molekylet ein då får, vert gjerne kalla Hb A1c eller glykosylert hemoglobin. Dersom konsentrasjonen av glukose i blodet aukar, vil òg prosentdelen av hemoglobin A som vert omdanna til Hb A1c auka. Hjå diabetikarar som ofte har høgt blodsukker, vil prosenten av Hb A1c også auka. På grunn av at hemoglobin A bind seg sakte til glukose, viser Hb A1c-prosenten eit gjennomsnittleg blodsukkernivå over ein lengre periode, seks til åtte veker.
Diagnostisk bruk[endre | endre wikiteksten]
Hemoglobinmåling er mellom dei oftast utførte blodprøvene, gjerne saman med teljing av dei ulike celletypane i blodet. Hemoglobinen vert gjerne målt i g/L, g/dl eller mmol/L. 1 g/dl er 0,62 mmol/l. Den gamle nemninga blodprosent vert ikkje nytta lenger, men ein hemoglobinverdi på 14,7 g/dl i blod tilsvarar om lag 100 % etter gamal rekning.
Glukoseinnhaldet i blod kan variera frå time til time, slik at ein, eller nokre få analysar på blodsukker ikkje treng visa sikkert kor god glukosereguleringa er hjå pasienten på lengre sikt. Ein blodprøve kan derfor analyserast på Hb A1c (glykosylert hemoglobin, «langtidsprøve»). Dette er meir representativt for blodsukkernivået over lengre tid (dei siste seks til åtte vekene). Diabetikarar med Hb A1c på 6,0 % eller mindre, er godt regulerte, ein verdi på over 7,0 % viser mindre god kontroll (ein godtek noko høgare verdi hjå eldre pasientar). Denne analysen er derfor svært nyttig ved kontroll av diabetikarar.
Sjå òg[endre | endre wikiteksten]
- Hemoprotein
- Hemocyanin
- Klorofyll
- Hemoglobin A1c (Glykosylert hemoglobin)
- Hemoglobin S
- Hemoglobin C
- Hemoglobin F
- Hemoglobin A2
Kjelder[endre | endre wikiteksten]
- Denne artikkelen bygger på «Hemoglobin» frå Wikipedia på engelsk, den 7. november 2005.
Bakgrunnsstoff[endre | endre wikiteksten]
- Interaktive hemoglobinmodellar Arkivert 2005-12-21 ved Wayback Machine.
