Atom
| Atom | ||||||||
|---|---|---|---|---|---|---|---|---|
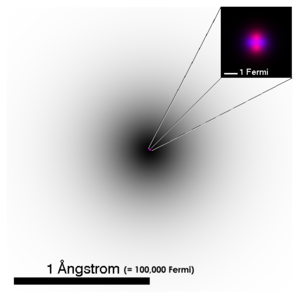 | ||||||||
| Figuren viser ein representasjon av strukturen for eit heliumatom. | ||||||||
| Klassifisering | ||||||||
| ||||||||
| Eigenskapar | ||||||||
|
Eit atom er innan kjemi og fysikk ein submikroskopisk struktur som som ikkje kan delast i mindre element via kjemiske reaksjonar og halde dei kjemiske eigenskapane sine. Atom er bestanddelar i molekyl (kjemiske stoff). Ordet atom kjem frå det greske ordet atomos som tyder udeleleg. Radiusen til eit atom er i området 31 (helium) til 215 (radium) picometer.
Tidlegare førestillingar om den fysiske strukturen til stoff var basert på at fysisk deling i stadig mindre bitar ville resultere i atomet som minste og udelelege bestanddel. I 1913 presenterte Bohr sin atommodell som deler atomet opp i tre underliggande elementærpartiklar:
- elektron, som har negativ elektrisk ladning og er minst av dei tre;
- proton, som har positiv ladning og er omkring 1836 gonger tyngre enn elektronet; og
- nøytron, som er elektrisk nøytrale og er omkring 1839 gonger tyngre enn elektronet.
Kvantemekanikken skildrar no materien sin bølgje-partikkel-dualitet og er det matematiske rammeverket for standardmodellen som skildrar krefter og partiklar på subatomært nivå. Elementærpartiklane blir no vidare delt opp i fleire typar partiklar til dømes kvarkar og kraftverknad mellom partiklar til dømes gluon. Atomære og subatomære partiklar kan ikkje sjåast som distinkt avgrensa fysiske objekt, men som ei romleg fordeling som gjev sannsynet for energien til partikkelen, utstrekking og posisjon til ulik tid. Eigenskapane til partiklane er ikkje lenger uavhengige men avheng av kva for andre partiklar dei opptrer i kombinasjon med. Dette vert kalla resonansar eller interaksjonar.
Skildringa av elementærpartiklar blir likevel brukt som modell for å forklare mange av eigenskapane til atomet og oppbygginga. I figuren over viser den grå skuggen posisjonen for elektrona i 1s orbitalet som eit integral over sannsynsfordelinga for bølgefunksjonen langs ei siktelinje. Den forstørra atomkjernen viser tilsvarande for protona i raudt og nøytrona i blått. I røyndomen er kjernen for 4He rotasjonssymmetrisk, dette er ikkje generelt tilfelle for meir komplekse kjernar.
Atoma er dei grunnleggjande byggeklossane i kjemien, og blir verna ved kjemiske reaksjonar men ikkje ved kjernereaksjonar.
Oppbygning og ladning[endre | endre wikiteksten]
Bestanddelane til atomet har etter den kvantemekaniske skildringa si inga klår avgrensing men blir skildra som energinivå i eit tredimensjonalt rom etter bølgjefunksjonen som blir skildra i Schrödingerlikninga. Vidare kan ein partikkel etter uskarpleiksrelasjonen vere å finne i ein kva for ein som helst avstand og retning. Men normalt er det høgt sannsyn for at partikkelen finn seg i eit avgrensa volum, og det er dette volumet som dannar bakgrunn for å gje storleik, avstand osv.
Storleiken til atomet skildrar statistisk radius for det ytste stabile orbitalet når atomet er i likevekt. For hydrogen er denne radiusen for 1s orbitalet og blir namngjeve Bohrs radius a0=5,3•10−11m. Men dette skal ikkje forståast som eit uttrykk for kor stor plass atomet tar. Faktisk avstand mellom to atom vil vere avhengig av om atoma er bunde eller ikkje og med kva for ein bindingstype. Til dømes er avstanden mellom H og O i vassmolekylet 9,6•10−11 m medan summen av atomradiane er (5,3+6,0)•10−11m = 1,13•10−10 m.
Atomkjernen består av proton og nøytron som blir kalla nukleonar. Mengda proton avgjer kva for eit grunnstoff atomet er og vert synt med atomnummer Z. Mengda nøytron avgjer isotopvarianten. Totalt mengd nukleonar blir namngjeve A. Det enklaste atomet er hydrogen som består av éit elektron bunde til éit proton. Eit atom av grunnstoffet «X» vert skildra som:
- eller ofte berre AX
Elementærpartiklane i kjernen har ein diameter på omkring 1,2•10−15m (Fermi radius r0) eller rundt 1/100 000 del av radiusen til atomet. Den typiske radiusen til kjernen er rn = r0 A1/3 og atomet består difor i stor grad av tomt rom. Forholdsmessig kan dette samanliknast med storleik og avstand mellom Sola og dvergplaneten Pluto (sjølv om partikkelsamanlikninga som såleis ikkje er haldbar).
Elektrona dannar ei elektronsky som omgjev kjernen. Normalt er atomet nøytralt ved at det har like mange elektron og proton. Dersom atomet har eit overskot eller underskot av elektron, blir det kalla høvesvis eit anion (negativt ladd ion) eller eit kation (positivt ion). Elektrona har fleire energinivå eller orbitalar. Bindingsenergien for elektronet i det lågaste orbitalet i hydrogen er 13,6 ev, og bindingsenergien fell med aukande orbital inntil elektronet er fritt og bindingsenergien er null (for hydrogen er EB = 13.6 eV/n2 der n er eit naturleg tal).
Nukleona er bundne saman med mykje høgare energinivå, typisk på 100 000 gonger høgare enn elektronbindinga og blir endra ved kjernefysisk fisjon, fusjon eller radioaktiv nedbryting. Slike prosessar blir òg kalla transmutasjon og omformar eit grunnstoff til eit anna.
Atom og molekyl[endre | endre wikiteksten]


Elektrona i dei høgaste orbitala har låg bindingsenergi og kan lett frigjerast. Dei vil difor utvekslast med nærliggande atom eller delast mellom fleire atom. Orbitala blir fylt opp frå lågaste nivåa, og spesielt mengda elektron i det øvste orbitalet avgjer mange av dei kjemiske eigenskapane til atomet. Ved hjelp av desse mekanismane blir det skapt kjemiske bindingar som dannar molekyl og elektronparbundne krystallstrukturar.
Molekyla vert bygd opp av fleire atom; til dømes er vatn ein kombinasjon av to hydrogen- og éit oksygenatom (H2O), medan vanleg oksygen i lufta er ein kombinasjon av to oksygenatom (O2). Desse har kjemiske eigenskapar som ofte er ulike frå dei grunnstoffa dei består av. Molekyl er dei minste einingane som eit stoff kan delast i og framleis bevare desse kjemiske eigenskapane.
I nokre stoff er atoma eller molekyla organisert i krystallstrukturar, dvs. at dei er organisert i romlege mønster som blir gjenteke i ulike retningar. Krystallet kan bestå av same eller ulike typar atom og/eller molekyl. Ein spesiell type krystall blir brukt i elektronikk-komponentar der krystallet er bygd opp av halvleiarar med små mengder andre atom som i stor grad endrar dei elektriske eigenskapane til krystallgitteret.
Atom der ytste orbital er heilt fylt opp, dannar vanlegvis ikkje kjemiske bindingar, og blir difor kalla edelgassar. Her vil dei einskilde atoma eksistere ubundne. Desse okkuperer gruppe 18 i det periodiske systemet.
I ein del stoff er det ikkje noko eigenleg molekyl- eller gitterstruktur. Desse har organiseringar utan nokre finstruktur på molekylnivå. Dette er tilfellet til dømes i smelta metall og amorfe bergarter og mineral.
Historikk og utviklinga av atommodellen[endre | endre wikiteksten]

Filosofiske funderingar over oppbygningen til materien går tilbake til Hellas i antikken og tidleg indisk kultur omkring 450 f.kr. Demokrit framsette teorien om at alt kan delast i stadig mindre stykke, inntil ein når ei nedre grense. Dei minste udelelege stykket kalla han for atom som tydde udeleleg. Desse ideane gjekk seinare tapt og vart først gjenoppdaga nesten 2000 år seinare, i samband med ny interesse for naturvitskap under renessansen.
John Dalton brukte i 1803 ideen om atomet for å forklare kvifor grunnstoffa alltid reagerer i same tilhøve, og kvifor nokre gassar vert betre løyst opp i vatn enn andre. Han framsette hypotesen at kvart grunnstoff består av atom av ein fast unik type, og at desse sameinast og dannar samansette kjemiske stoff.
I 1897 oppdaga JJ Thomson elektronet som eit resultat av arbeid med katodestrålar. Dette viste at atomet kan delast i mindre einingar. Seinare oppdaga Thomson eksistensen av isotop gjennom arbeidet med ioniserte gassar. Thomson rekna at elektrona var jamt fordelt i eit atom med ei utstrekt positiv ladning som gjer atomet nøytralt (plumpudding-modellen).
Men i 1909 viste Rutherfords gullfolieeksperiment at den positive ladningen til atomet og størstedelen av massen truleg er samla i ein atomkjerne, og at elektrona sirklar rundt denne som planetar rundt sola. Rutherfords atommodell vart framsett i 1911, men alt i 1913 presenterte Niels Bohr sin atommodell som innførte kvanteomgrepet. Elektrona vart no kvantifisert i klårt definerte banar og kunne ikkje lenger spiralisere inn og ut.
I 1926 foreslo Erwin Schrödinger at elektrona oppførte seg som bølgjar. Som ei følgje av dette viste Werner Heisenberg eit år seinare at det ikkje er matematisk mogleg å måle tilstanden til ein partikkel (posisjon og moment) til ei gjeven tid heilt nøyaktig. Dette usikkerheitsprinsippet medførte at atommodellen til Bohr vart erstatta med ei skildring der det ikkje er mogleg å gje posisjonane til elektrona, berre sannsynet for at dei finn seg innan visse soner.
Frå tidleg på 1970-talet har standardmodellen gjeve ei samla skildring av elementærpartiklar og krefter på subatomært nivå. Han har gjeve ei rekkje teoretiske føreseiingar som seinare er vorte eksperimentelt verifisert med stor nøysemd. Teorien har likevel enno ei rekkje veikskapar som at han inneheld mange eksperimentelt bestemde (ikkje berekna) konstantar, og at han ikkje inkluderer gravitasjon
Eigenskapane til atomet innanfor gjeldande teori[endre | endre wikiteksten]
Subatomære partiklar[endre | endre wikiteksten]

Inntil 1961 vart atomet rekna for å bestå berre av elektron, nøytron og proton. Standardmodellen som vart utvikla tidleg på 1970-talet, skildrar dei partiklane og krefter som byggjer opp subatomære partiklar. Kvarkar kjem i tre par (6 variantar) med ladning høvesvis +2/3 og -1/3 og spinn ½. Dei finst ikkje fritt, men er alltid bundne saman i baryonar med tre kvarkar som får ½ heiltals spinn og mesonar med to kvarkar og heiltals spinn. Elektronet saman med partiklar som positron og nøytrino er leptonar og blir ikkje påverka av den sterke kjernekrafta. Familiane leptonar og bosonar er begge fermionar som er partiklar med ½ heiltals spinn.
Protona og nøytrona er baryonar og blir bygd opp av u- (opp) og d- (ned) kvarkar som har såkalla fargeladning i tillegg til at dei har elektrisk ladning. Protonet får med kombinasjonen (uud) ein positiv elektrisk elementærladning medan nøytronet med (udd) blir elektrisk nøytralt. Kvarkane blir saman halde av den såkalla fargekrafta formidla av gluonar som er vekselverknadsbosonar. Størstedelen av energien i nøytronet og protonet kjem ikkje frå opp ned kvarkane (med 4 og 8 MeV) men ligg i bindingsenergien som gjev dei massar på høvesvis 938,3 og 939,6 MeV. Protona og nøytrona er fargenøytrale. Men fargeladningen er ujamt fordelt i dei slik den elektriske ladningen er ujamt fordelt i molekyl. På tilsvarande måte som det gjev opphav til bindingskrefter mellom molekyl, gjev den ujamne fordelinga av fargeladning i protona og nøytrona opphav til sterk kjernekraft eller nukleon-til-nukleon-krafta som held atomkjernane saman, trass i den elektriske fråstøytinga mellom protona.
Foton er masselause elektromagnetiske bølgjer (partiklar) med heiltals spinn som formidlar den elektromagnetiske krafta. Denne virkar mellom elektronet og kjernen og saman med elektronet sin bølgjenatur vert det danna orbitala.
Elektron og elektronskal[endre | endre wikiteksten]
Atomkjernane er omgjeve av elektrontåker, og det er primært desse tåkene som avgjer korleis atoma virkar på kvarandre og kva for kjemiske bindingar som oppstår. Desse tåkene representerer sannsynsfordelingar for elektrona og delast opp i orbitalar som svarar til faste energinivå for elektrona. Desse orbitalane blir òg kalla elektronskal. Kvart orbital har berre plass til ei bestemt mengd elektron fordi alle elektrona i same atom må vere i ulik kvantemekanisk tilstand (for elektronet er dette kombinasjonen av hovud-, bi- magnetisk- og spinn-kvantetal etter bestemde reglar). Orbitalane aukar i storleik og kompleksitet med aukande energinivå inntil elektronet er ionisert og dermed frigjort frå kjernen.

Elektrona kan i prinsippet vere i eit kva for eit som helst orbital, men vil i grunntilstanden fylle opp orbitala frå lågaste (inste) nivå. Eit eksitert elektron er i eit høgare orbital enn grunntilstanden, og vil raskt falle tilbake til ein ledig plass i eit lågare orbital og gje frå seg energien i form av eit foton.
Elektrona i ytste «folkesette» skal i grunntilstanden kallast valenselektron og avgjer i vesentleg grad korleis elektronet forbind seg kjemisk med andre atom. Generelt vil atoma som blir bundne saman, dele på eit eller fleire elektron i ytste skala. Atoma søkjer å fylle opp dette skalet. I vatn (H2O) er dei ytste skala til hydrogenet 1s1 og kan difor gje frå seg eller ta opp eit elektron. Oksygen har ytste skala 2p4 som kan gje frå seg 4 eller ta opp 2 elektron. Oksygenet kan difor dele på eit elektron frå kvart hydrogenatom for å fylle det ytste skalet sitt, og hydrogenet dele eit elektron med oksygenet for å fylle sitt. I hydrogengass (H2) vil begge hydrogenatoma fylle 1s skalet ved å dele på dei to elektrona. Edelgassane har alle fullt ytste skal og reagerer difor vanskeleg med andre stoff.
Atoma blir plassert i grupper og periodar i det periodiske systemet, der perioden tilsvarar mengder orbital eller elektronskal, og mengder ledige plassar i ytste skala fell frå venstre mot høgre i gruppa. På denne måten viser ein grunnstoff med nærskylde eigenskapar nær kvarandre.
Elektrona i skala innanfor kallast kjerneelektrona og hovudeffekten av desse kjem i form av skjerming av den positive ladinga til kjernen. Dette avgjer delar av atomet sitt elektronegativitet og avgjer evna til å tiltrekke felles elektron i ei binding mellom fleire atom. Elektronegativteten aukar med mengder elektron i ytste skal, og minkar med mengder kjerneelektron.
Dersom skilnaden i elektronegativitet er mindre enn 0,4 trekk atoma omtrent like mykje på elektrona og desse vil fordele seg jamt mellom atoma. Dette blir kalla ein kovalent binding og opptrer til dømes i vanlege gassar som O2, H2 og N2.
Ved skilnad større enn 1,4 får ein ei ionebinding. Atomet med høgast elektronegativitet vil tiltrekke seg dei fleste elektrona og bli meir negativt ladd. Samstundes blir elektron trekt frå dei (det) andre atoma, noko som reduserer skjerminga av kjernen og gjev positiv ladning. Slike molekyl er dipolar og organiserer seg i retningsorienterte strukturar med positive ender mot negative ender. Eit døme er vanleg salt (NaCl) som vist i krystallgitteret tidlegare.
Ved skilnad mellom 0,4 og 1,7 oppstår ein polar kovalent binding. Spesielt dersom nokre av atoma er hydrogenatom er denne viktig sidan protonkjernen lett blir avskjerma og difor dannar hydrogenbindingar til elektronegative atom i andre eller same molekyl, noko som gjev opphav til spesielle eigenskapar. Dette er til dømes tilfelle i vatn (H2O) og meir komplekse organiske molekyl som protein, DNA og polysakkarid. Protein har ulike eigenskapar etter korleis dei er «kveila opp» og denne strukturen blir stabilisert av hydrogenbindingane.
Eigenskapar for nukleonar og atomkjernen[endre | endre wikiteksten]
Fargekrafta bind kvarkar saman og byggar opp nukleonar som proton og nøytron som dannar atomkjernar. Atomkjernen har ein statistisk storleik på der r0=1,2•10−15m er Fermi radius.
Fargekrafta mellom kvarkane i protona og nøytrona har ei residuell kraft (sterk kjernekraft) som bind dei einskilde nukleona i atomkjernen saman. Han fell særs raskt av, typisk 1/r7 på avstandar over 1,4•10−15 m og bind i det vesentlege nukleonet til dei næraste naboane sine. Den elektromagnetiske krafta har lang rekkjevidd og får vesentlege bidrag frå alle proton i kjernen. Ved høgare atomnummer blir difor kravd relativt fleire nøytron (noko som styrkjer den sterke kjernekrafta i atomkjernen) for å halde kjernen saman og skape balanse mellom desse kreftene.
Ulike isotopar kan difor vere ustabile og endre mengder nukleonar ved kjernereaksjonar som radioaktiv nedbryting eller spalting (kjernefysisk fisjon). Når dette skjer spontant kallast det radioaktivitet og har ein karakteristisk halveringstid som skildrar gjennomsnittleg tid før halvparten av atoma i eit utval er spalta. Dette kan skje på ulike måtar:
- Ved alfastråling sendast det ut ein heliumkjerne (Z=2). Eit døme er spalting av uran (Z=92) til thorium (Z=90) og ein alfapartikkel (4He).
- Ved betastråling som inneber at eit nøytron går over til eit proton ved svak vekselverknad og sender ut eit elektron.
- Som for elektrona kan òg nukleona eksiterast til høgare energi, og sender ut eit foton når dei går tilbake i grunntilstanden. Men desse energinivåa har fleire tusen gonger større energi enn dei atomære energinivåa, og fotonet får tilsvarande høg energi. Foton med slike energiar blir kalla gammastråling.
Kjernefysiske reakjonar kan òg framkallast ved hjelp av partiklar med høg energi (nukleonar, elektron eller foton). Dei føregår òg ved at to kjernar smeltar saman ved kjernefysisk fusjon og når eit proton tilførast energi og går over til eit nøytron ved svak vekselverknad.
Storleiken til atom og fart[endre | endre wikiteksten]
Storleiken til atoma er omkring 1/1000 av bølgjelengda for synleg ljos. Difor kan ikkje atom observerast direkte i optiske instrument. Men strukturen til atoma på overflata av ein tynn film kan registrerast til dømes med skannande tunnelerande mikroskop (STM), ved nukleær magnetisk resonans (NMR) og i røntgenstrålemikroskop.
Fordi elektronskya som omgjev kjernen ikkje har noko skarp avgrensing, er storleiken på atomet eit definisjonsspørsmål. Tal frå ulike kjelder kan ikkje nødvendigvis samanliknast utan nærare definisjon. Vanlege storleikar som blir oppgjeve er (generelt i stigande rekkjefølgje):
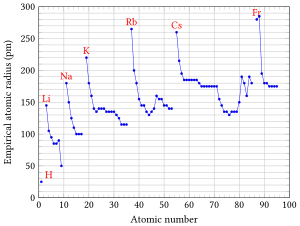
- Radiusen til atomet er lik statistisk radius for ytste stabile orbital i grunntilstanden. Berekna atomradius er ofte mindre eller større enn empirisk atomradius (For H 50 % større enn empirisk).
- Kovalent radius er halve avstanden mellom to identiske atom (som då har kovalent binding eks. H2)
- Wan der Waals radius oppgjev radius for eit imaginært skal som blir avgjort ved røntgendiffraksjon på ubundne atom i eit krystallgitter.
Basert på det som er skildra over har karbon(12C) ein kjernestorleik på ~2,8•10−15m medan kovalent radius er 7,0•10−11m eller ein faktor 25 000 gonger større. Dette tilsvarar omtrent ein ert (8 mm) i midten av eit fotballstadion (200 m).
Den klassiske radiusen til elektronet er òg ~2,8•10−15m, der storleiken til elektronet er basert på elektromagnetisk energitettleik. I dag reknast likevel elektronet kvantemekanisk som ei punktladning utan definert utstrekking.
Atomkjernen har omtrent heile massen til atomet, for 12C er massen ~2,0•10−26kg konsentrert innan eit volum på ~9,2•10−44m³. Spesifikk vekt for kjernen er difor ~2,2•1017 kg/m³. Nøytronstjerner kan oppnå ein slik pakketettleik når kjernen kollapsar etter visse typar supernovaer.
Atommassen oppgjevast ofte i atommasseeininga u og stoffmengde i mol. Desse einingane blir basert på 12C som standard; 1 u er 1/12 av massen for 12C, og 1 mol er mengder karbonatom i 12 gram 12C, som er Avogadrotalet 6,0221415•1023. Generelt er 1 mol av eit stoff X gram når atomvekta i atommasseeiningar er X.
Radiusen til atomet står i lita grad i tilhøve til atommassen. Atom med høgare atomnummer har høgare ladning i kjernen, og vil pakke elektronskya tettare, noko som medfører at radiusen til orbitala reduserast. Storleiken har eit gjennomsnitt på ~140 picometer (pm) for alle atom, og med unntak av periode 1 og 2 ligg dei aller fleste grunnstoffa i området 110-215 pm. Aluminium med atomvekt 27u har kovalent radius 118 pm. Iridium har omtrent same radius (137 pm) men atommasse 192u, og dette forklarar i stor grad skilnaden i tettleik mellom aluminium (2700 kg/m³) og iridum som har den høgaste tettleiken av grunnstoffa med 22 650 kg/m³.
Temperaturen i ei samling atom er eit mål på midlarar kinetisk energi (rørsleenergi) for atoma, utover den kvantemekaniske rørsla som følgjer av uvisseprinsipeet. Midlarar fart aukar frå null ved 0 K til omkring 500 m/s ved romtemperatur. Rørslene er likevel uregelmessige Brownske rørsler og fører ikkje til netto forflytting av atoma.
Grunnstoff, isotopar og ion[endre | endre wikiteksten]
Atom med same atomnummer Z har ei lang rekkje fysiske eigenskapar felles, og oppviser tilnærma like kjemiske eigenskapar. Difor klassifiserer ein alle atom med same mengder proton i kjernen og dermed same atomnummer som same grunnstoff. Til dømes vil alle atom med seks proton i kjernen (Z = 6) klassifiserast som karbon.
Massetalet A gjev mengda nukleonar i atomkjernen, dvs. summen av proton og nøytron. Han er samanliknbar med atommassen i atommasseeiningar. Eit spesifikt sett nukleonar med Z proton og A-Z nøytron blir kalla ein nuklide.
Eit grunnstoff kan ha fleire ulike nuklidar, alle med same atomnummer Z (mengder proton og elektron), men ulik mengd nøytron. Dette settet av nuklidar blir kalla isotopar av grunnstoffet. Isotop tyder «same stad», fordi dei har same kjemiske symbol og plass i det periodiske systemet. 14C eller Karbon-14 er ein slik isotop av karbon og har 6 proton og 8 nøytron i kjernen, som gjev massetal 14. Isotoptabellen viser alle kjende isotopar av grunnstoffa. Atommassen som blir oppgjeve er eit snitt av isotopmassen for alle isotopar vektlagt etter kor relativt vanleg dei er i naturen.
Det enklaste atomet er protium, den vanlegaste isotopen av hydrogen, med berre éit proton og éit elektron. Hydrogen med éit proton og éit nøytron blir kalla deuterium, medan tritium har éit proton og to nøytron. Tritium er radioaktivt og har ei halveringstid på 12,23 år og går då over til helium isotopen 3He og dessutan eit elektron og eit elektron antinøytrino som alle er stabile. Mange isotopar er radioaktive, og mengder stabile isotopar varierer sterkt frå grunnstoff til grunnstoff. Tinn (Sn, Z=50) har 10 stabile isotopar, medan bly (Pb, Z=82) er det høgaste atomnummeret som har stabile isotopar. Høgare atomnummer Z≥83 har ingen stabile isotopar og er alle radioaktive.
Dei fleste atoma som er lettare enn uran (U, Z=92) har éin eller fleire isotopar med lang nok levetid til å finnast på jorda. Nokre unntak er technetium (Tc, Z=43) og promethium (PM, Z=61) som berre kan identifiserast i stjerner der dei nyleg er vorte syntetisert. Dette gjeld òg transuranar, dvs. tyngre atom enn uran med kort levetid.
Fleire tyngre atom som ikkje finst naturleg har vorte framstilt ved bombardering av andre kjernar med høg energi. Nye grunnstoff har vorte skapt på denne måten opp til atomnummer 116, med førebels namn ununhexium. (Nedbrytningsprodukt av ununoctium, Z=118 har òg vorte observert)[1] Slike tunge grunnstoff er svært ustabile og nedbrytast raskt.
Etter Big Bang bestod vanleg masse i universet av 76 % hydrogen og 24 % helium, og mindre enn 1 % av nokre få andre lette atom. Alle andre grunnstoff er danna seinare ved nukleosyntese i stjerner og supernovaer. Sola er er ei tredje generasjons stjerne, og solsystemet inneheld stoff etter to tidlegare generasjonar stjerner og har difor ei viss mengd tyngre grunnstoff.
Atoma kan gje frå seg eller oppta elektron. Når mengder elektron er ulikt frå mengda proton i kjernen er atomet ikkje elektrisk nøytralt. Atom med underskot på elektron er positivt ladde og kallast kationar fordi dei vil trekkjast mot katoden (negativ elektrode). Når det er overskot på elektron er ladninga negativ, og ionet er eit anion, namnet kjem fordi dei blir trekt mot den positive anoden.
Atomspekter[endre | endre wikiteksten]

Kvart grunnstoff har eit spesifikt sett orbitalar for sin elektronkonfigurasjon. Desse orbitalane har energinivå og sprang mellom desse energinivåane som er unike for same grunnstoff og ulikt for ulike atomnummer. Når eit elektron eksiterast, dvs. blir tilført energi frå eit foton og går til eit ledig høgare orbital vil dette krevje ei fast energimengd som er lik energispranget mellom desse orbitalane. Atom i eit høgare orbital vil raskt gå til eit lågare orbital dersom dette har ein ledig plass, og vil då tilsvarande gje frå seg eit foton med ein energi lik energispranget mellom orbitalane. Energien til fotonet tilsvarar ein spesifikk frekvens og bølgjelengd (=farge i det synlege området).
Kvart grunnstoff får på denne måten eit unikt sett av bølgjelengder som kan absorberast eller emitterast. Ved spektroskopi brukast dette ved at ei prøvetaking vert bestrålt frå ei intensiv lyskjelde. Elektrona vil då eksiterast, og når desse eller andre elektron inntar den lågare ledige posisjonen vert det sendt ut foton. Det resulterande emisjonsspekteret blir brukt til å analysere kva for grunnstoff som er tilstades og dei relative mengdene deira.
Tilsvarande vil atom som blir gjennomlyst med eit kontinuerleg spektrum, vise eit absorbsjonsspekter med mørke linjer tilsvarande kvantespranga. Ljos frå stjerner (og sola) som passerer gjennom fotosfæren til stjerna, interstellare gasståker eller atmosfæren til planetar vil kunne vise deira kjemiske sammensetning på denne måten. Stjernene sjølv er optisk opake til fotosfæren (den lysande solskjeva) og ljoset blir emittert, blir absorbert og reemitterast difor i mange omgangar. Spektrumet til sjølve stjerna er difor kontinuerleg. Linjene vil ofte vere forskyvd i spekteret på grunn av høg relativ fart eller ekspansjonen til universet og kan difor gje ytterlegare informasjon om dette.
Energinivåa finn ein i heile det elektromagnetiske spekteret frå låg energi radiobølgjer til høgenergi røntgenstråling. Låge energinivå oppstår ved små energisprang i høgare orbitalar eller i spinn som den viktige hydrogenlinja ved 0,21 m (1420,40575 MHz). Høgenergifoton oppstår i tunge atom når posisjonar i låge orbitaler frigjerast ved at elektrona eksiterast til dømes av betastråling og elektron frå høge orbitaler tek plassen deira.
Illustrasjonar av storleiken til atomet[endre | endre wikiteksten]
Nokre døme som viser storleiken til atomet:
- Eit HIVvirus er omtrent 800 karbonatom breitt og inneheld rundt 100 millionar atom
- Ein E. colibakterie er rundt 30 000 karbonatom tjukt og inneheld kanskje 100 milliardar atom.
- Eit støvkorn kan innehalde meir enn 3•1012 (3 billionar) atom.
- Eit menneskehår er omtrent 1 million karbon atom tjukt, og eit 10 cm langt hår har rundt 1015 atom
- Mengder atom i 12 gram kol (1 mol) er 6•1023, kanskje 10 gonger mengder sandkorn på jorda.
- Mengder atom i det observerbare universet er rundt 6•1079
Sjå òg[endre | endre wikiteksten]
- Atomteori
- Atommodell
- Ionisering
- Kvantemekanikk
- Kjemiske bindingar
- Orbital
- Partiklar i standardmodellen
- Periodesystemet
- Isotoptabell
Kjelder[endre | endre wikiteksten]
- Denne artikkelen bygger på «Atom» frå Wikipedia på bokmål, den 9. april 2012.
- Wikipedia på bokmål oppgav desse kjeldene:
- ↑ Viktor Ninov, K. E. Gregorich, W. Loveland, A. Ghiorso, D. C. Hoffman, D. M. Lee, H. Nitsche, W. J. Swiatecki, U. W. Kirbach, C. A. Laue, J. L. Adams, J. B. Patin, D. A. Shaughnessy, D. A. Strellis, P. A. Wilk. «Observation of Superheavy Nuclei Produced in the Reaction of 86Kr with 208Pb». Physical Review Letters 83 (6-9): 1104-1107. doi:10.1103/PhysRevLett.83.1104.
- Michael Mansfield og Colm O'Sullivan (1998). Understanding Physics. John Wiley & Sons. ISBN 0-471-97553-2.
- Brian Martin (2006). Nuclear and Particle Physics: An Introduction. John Wiley & Sons. ISBN 0-470-01999-9.
- Kenneth S. Krane (1987). Introductory Nuclear Physics. John Wiley & Sons. ISBN 0-471-80553-X.
Bakgrunnsstoff[endre | endre wikiteksten]
- Hyperphysics Hyperphysics, Department of Physics and Astronomy, Georgia State University
- Wikibooks FHSST Physics Atom:The Atom Arkivert 2006-06-13 ved Wayback Machine.



